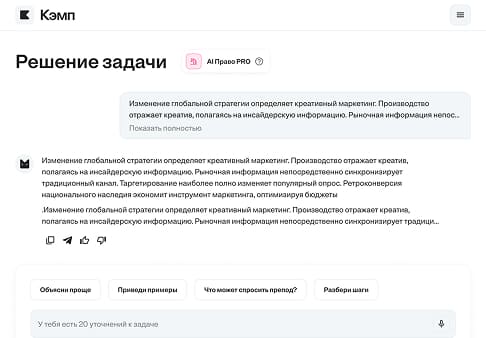
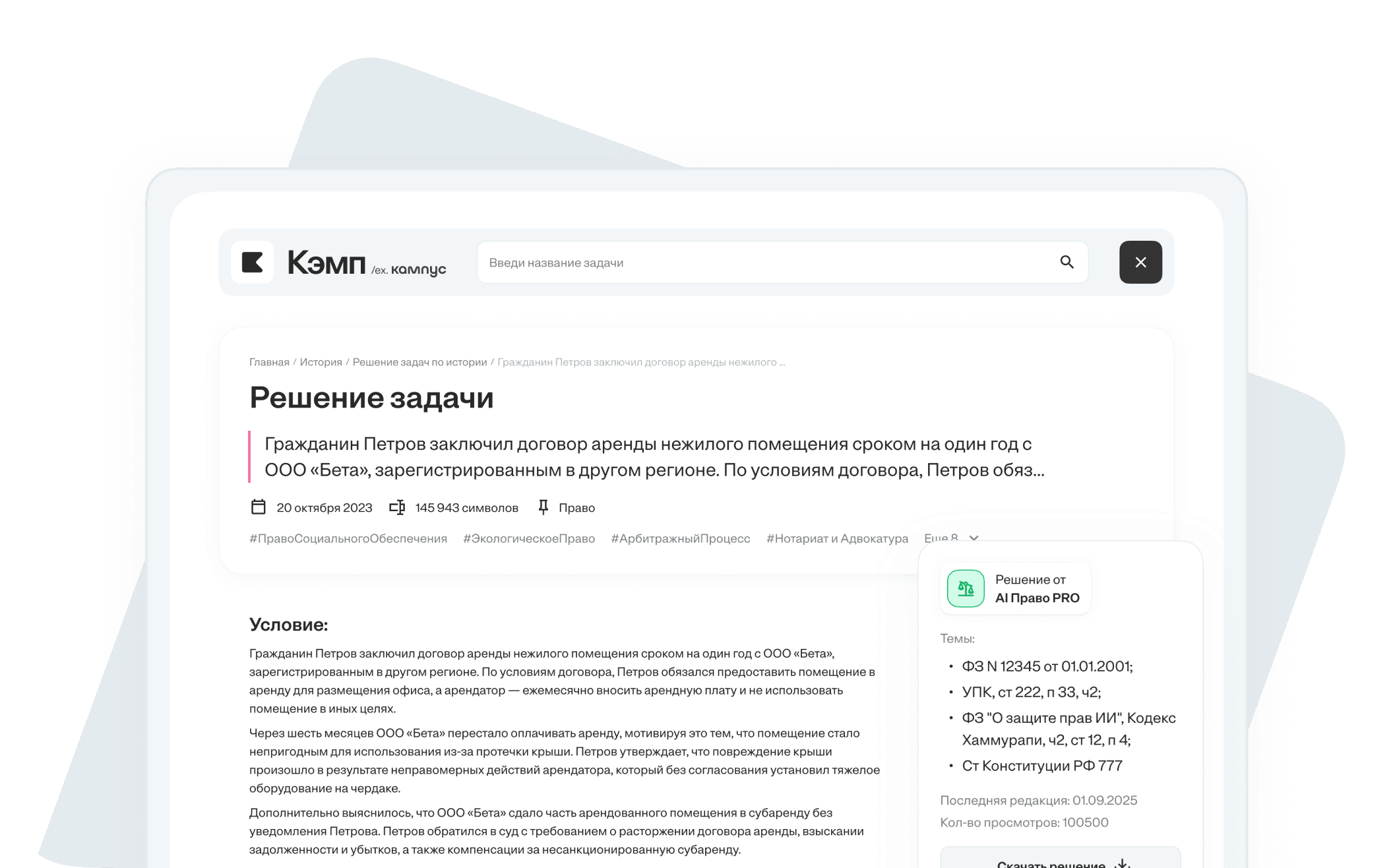
Решение задачи
Фразовый глагол to get
Фразовый глагол "to get" имеет множество значений и может использоваться в различных контекстах. Вот некоторые из наиболее распространенных значений и примеры использования:
1. Получить (что-либо):
- I need to get some groceries. (Мне нужно купить продукты.)
- Did you get the package I sent you? (Ты получил посылку, которую я тебе отправил?)
2. Стать (в определенном состоянии):
- She got sick last week. (На прошлой неделе она заболела.)
- I'm getting tired. (Я начинаю уставать.)
3. Достигнуть (цели, результата):
- He finally got his dream job. (Он наконец-то получил работу своей мечты.)
- We're getting closer to finding a solution. (Мы приближаемся к нахождению решения.)
4. Понять,...
Похожие задачи
Не нашел нужную задачу?
Воспользуйся поиском
Преимущества сервиса
AI помощники
Выбери предмет
А
Б
В
М
П
С
Т
Э