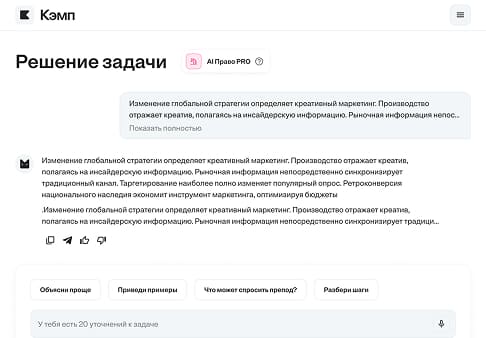
При электролизе бромида одновалентного металла, содержащего 41,2 г этой соли, выделилось 4,48 л водорода (н.у.). Определите, бромид какого м...
Условие:
Решение:
Для решения этой задачи, нам необходимо использовать данные о выделении водорода при электролизе бромида одновалентного металла.
- Рассчитаем количество вещества бромида одновалентного металла, содержащегося в 41,2 г этой соли. Для этого воспользуемся формулой:
моль = масса / молярная масса
Молярная масса бромида одновалентного металла зависит от его идентичности, поэтому нам необходимо знать, какой металл был использован. Предположим, что это натрий (Na).
Молярная масса NaBr = масса Na + масса Br = 22,99 г/моль + 79,90 г/моль = 102,89 г/моль
Количество молей NaBr = 41,2 г / 102,89 г/моль = 0,4 моль
- Теперь, когда у нас есть количество молей NaBr, мы можем определить, какой объем водорода был выделен при электролизе. По уравнению электролиза, каждый моль NaBr дает 1 моль водорода:
1 моль NaBr -> 1 моль H2
0,4 моль NaBr -> 0,4 моль...