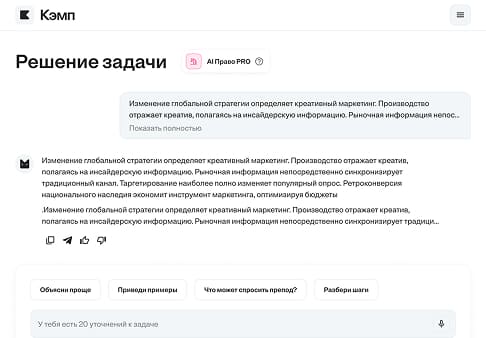
При сгорании 1,5 г вещества образовалось 2,2 г оксида углерода (IV) и 0,9 г воды. Относительная плотность этого вещества по азоту равна 3,22...
Условие:
Решение:
Для определения молекулярной формулы вещества, нам необходимо сначала определить количество молей каждого элемента в оксиде углерода (IV) и воде.
Масса оксида углерода (IV) составляет 2,2 г, а масса воды - 0,9 г. Чтобы определить количество молей каждого элемента, воспользуемся молярной массой.
Молярная масса оксида углерода (IV) (CO2) равна 44 г/моль, а молярная масса воды (H2O) равна 18 г/моль.
Количество молей углерода в оксиде углерода (IV) можно определить, разделив массу оксида на его молярную массу:
Количество молей углерода = масса оксида углерода (IV) / молярная масса оксида углерода (IV) = 2,2 г / 44 г/моль = 0,05 моль.
Количество молей водорода в воде можно определить аналогичным образом:
Количество молей водорода = масса воды / молярная масса воды = 0,9 г / 18 г/моль = 0,05 моль.
Таким...